自闭症谱系障碍(ASD)是一类由遗传和环境因素共同作用导致的神经发育疾病,患者的核心症状表现为社交障碍以及重复刻板行为。ASD发病率逐年升高,但目前尚缺乏有效的治疗手段。试图通过改变影响ASD发生发展的环境因素来缓解ASD症状,尤其是核心症状,逐渐成为了近年来探索治疗ASD的热点。越来越多的研究表明肠道微生物能够有效调节神经活动并且影响中枢神经系统相关的行为。同时已有研究表明肠道微生物可以通过肠-脑轴这条双向通路与中枢神经系统进行沟通交流。但是,在ASD的状态下,肠道微生物如何调节与ASD相关的神经活动知之甚少。此外,能否通过肠道干预而治疗ASD目前仍然缺乏足够的证据。
2022年3月3日,北京生命科学研究院赵方庆团队在Nature Communications上发表研究论文“Changes to gut amino acid transporters and microbiome associated with increased E/I ratio in Chd8+/? mouse model of ASD-like behavior”,报道了他们在肠道微生物-肠-脑轴调控ASD的机制研究方面的最新成果。该团队从解析ASD动物模型在神经系统和肠道的表型入手,通过开展菌群定植实验和药物干预实验,研究了肠道微生物对ASD中神经活动的调控机制。研究首次阐明了氨基酸转运体在肠道微生物调节与ASD相关的神经活动中的作用,揭示了肠道微生物-肠-脑轴双向沟通的新机制。
该研究团队选择染色质解旋酶DNA结合蛋白8杂合敲除的小鼠(Chd8+/-)作为研究ASD中肠道微生物调节神经活动的动物模型。首先,该团队评估了Chd8+/-小鼠的ASD样行为并揭示了Chd8+/-小鼠表现出ASD样行为的机制。在神经递质水平,Chd8+/-小鼠表现为兴奋性神经递质谷氨酸水平升高,导致兴奋性神经递质和抑制性神经递质(γ-氨基丁酸)的比例增加。同时,脑中和外周血中谷氨酸的前体物质谷氨酰胺水平升高。为了验证肠道对氨基酸的吸收是否参与了外周血中的氨基酸水平异常,该团队进行了肠道单细胞转录组测序,发现肠道上皮细胞中氨基酸的转运体表达量增加,这一发现也在蛋白水平上得到了验证(图1)。
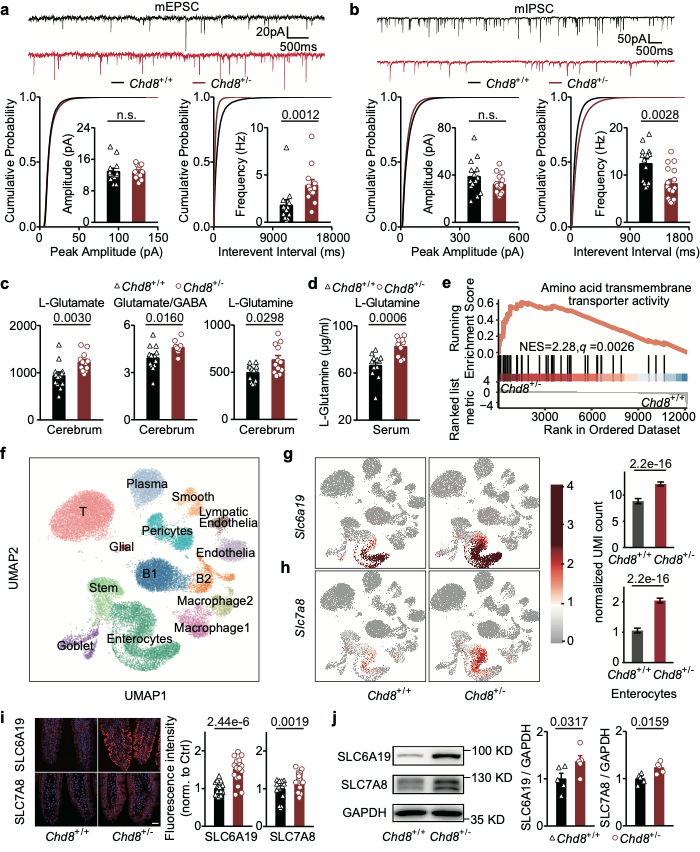
图1. Chd8+/-小鼠模型的兴奋抑制不平衡
该团队进一步探索了Chd8+/-小鼠的肠道微生物,发现Chd8+/-小鼠发生了以拟杆菌属水平减少为特征的肠道菌群紊乱,并证实了宿主通过调节肠道防御素而影响肠道菌群组成。为了探索肠道微生物紊乱在Chd8+/-小鼠ASD样行为中的作用,对Chd8+/-小鼠进行了共饲养实验,发现与Chd8+/+小鼠共饲养纠正了的Chd8+/-小鼠的肠道微生物紊乱和相应的ASD样行为。随后,挑选了单形拟杆菌这一变化幅度最大的拟杆菌对Chd8+/-小鼠进行单菌定植实验,发现补充单形拟杆菌纠正了肠道氨基酸转运体的表达水平、脑中异常的谷氨酸和谷氨酰胺水平以及ASD样行为。最后,为了探索肠道微生物是否通过调节肠道氨基酸转运体而调节外周血中谷氨酰胺的水平,进而调节脑中的谷氨酰胺以及谷氨酸水平,最终影响兴奋/抑制不平衡,该团队使用了肠道氨基酸转运体的抑制剂,发现该抑制剂可以起到和单形拟杆菌相似的作用(图2)。
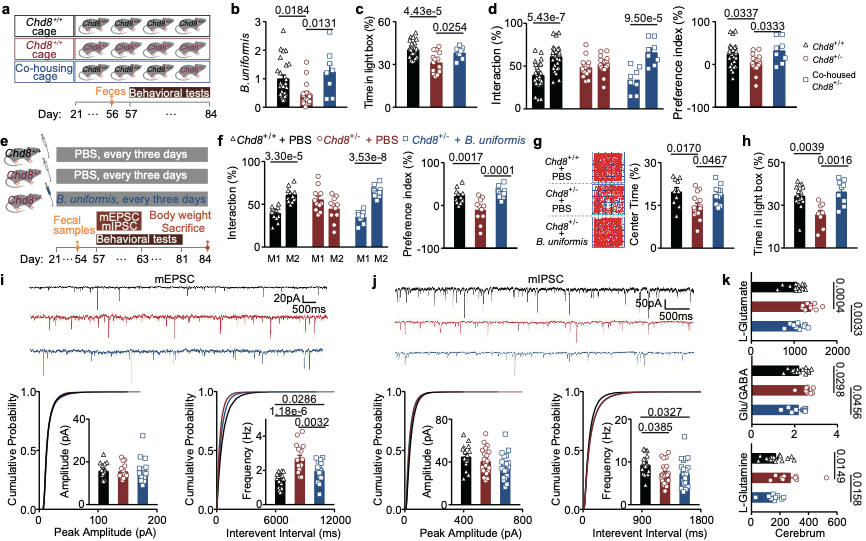
图2. 单形拟杆菌干预对兴奋抑制不平衡及行为表型的恢复作用
该研究首次阐明了肠道氨基酸转运体在肠道微生物调节与ASD相关的神经活动中的作用,揭示了肠道微生物调控神经系统的新机制,完善了肠道微生物-肠-脑轴双向沟通的理论基础(图3)。在此基础上发现了肠道微生物和肠道氨基酸转运体抑制剂能够纠正ASD相关的行为,尤其是社交障碍这一核心症状,提示肠道干预有可能作为ASD临床治疗的有效手段。此外,研究进一步证实了肠道微生物和宿主在ASD发生发展和治疗中的相互作用: 宿主通过调控肠道防御素水平而影响肠道微生物的组成,而肠道微生物通过调节肠道氨基酸转运体而调控宿主神经活动。
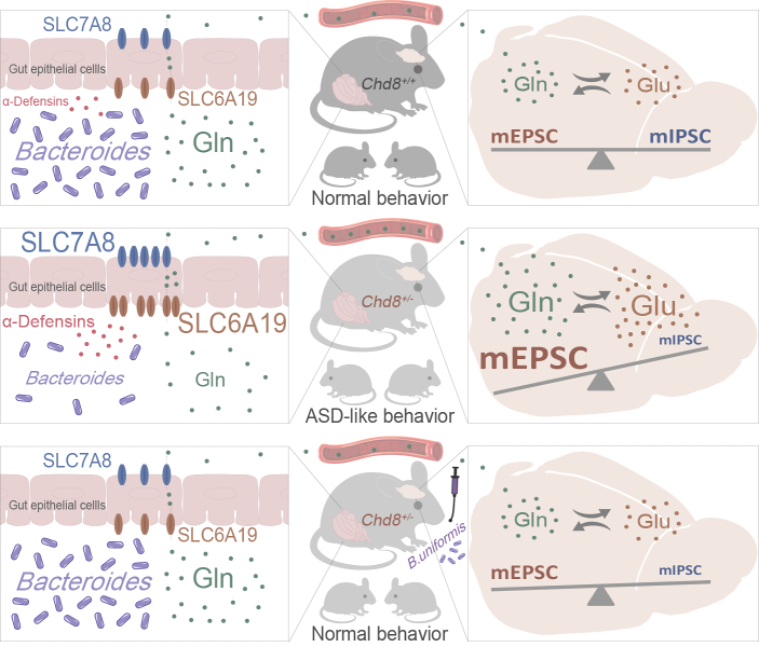
图3. Chd8+/-小鼠模型中肠道微生物-肠-脑轴互作机制
中科院北京生科院博士后于游、博士研究生张冰和副研究员冀培丰为论文的并列第一作者,赵方庆研究员为通讯作者。该工作获得了国家杰出青年科学基金、科技部重点研发计划和中国科学院战略先导专项的支持,在肠道微生物菌株分选上得到了中国科学院微生物研究所刘双江研究员及其团队的大力支持。赵方庆团队在前期工作中针对复杂菌群结构和功能的精准解析问题,建立了一系列新技术和新方法,相关研究发表在Cell (2020)、Gut (2020, 2018)、Nature Communications (2022, 2021, 2017)、Genome Biology (2021, 2016)、ISME J (2019)、Microbiome (2017)、Nucleic Acids Res (2016)。这些研究丰富了我们对复杂微生物组结构组成、动态演替和功能的认识,为深入理解肠道微生物与宿主互作提供了理论依据和方法学基础。
原文链接:https://www.nature.com/articles/s41467-022-28746-2.

